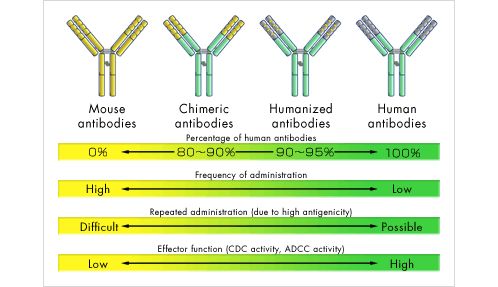
2008 年, Tiller 等人發明了一種從人外周血單個核細胞快速制備單克隆抗體的方法。其主要過程包括: 經流式分選出抗原特異性單個B 細胞, 單細胞RT-PCR 與巢式PCR 組合獲取抗體重鏈和輕鏈的可變區基因信息, 將這些基因克隆并在真核系統中表達。單個B 細胞的分離可以分別通過“隨機分選”或者“抗原特異性分選”兩種途徑進行。“隨機選擇”的主要方法有基于顯微操作的細胞分選、流式細胞分選技術等。“抗原特異性分選”的主要方法有抗原包被的磁珠分離、熒光包被的抗原多參數流式細胞分選等。此外, 近年來快速發展的單細胞測序技術使得研究人員能夠更低成本、更大規模地獲得B 細胞抗體基因。同時, 細胞微陣列芯片、顯微雕刻技術和免疫斑點陣列芯片技術也為高通量篩選單克隆抗體分泌細胞提供了條件。與各種抗體展示技術相比, 單細胞抗體基因擴增技術能快速、直接地獲得人源抗體, 特別適合在突發傳染病等情況下發現有保護性的單克隆抗體。由于通過小鼠雜交瘤技術制備的單克隆抗體是非人源性的, 應用于人體不可避免地會引起人抗鼠抗體反應,導至藥物療效降低, 或者引起過敏反應, 甚至威脅生命,限制了單克隆抗體的臨床應用。為了克服這種缺陷, 20世紀80 年代中期, 研究者們尋求以基因工程技術對鼠源性單克隆抗體進行改造優化, 嘗試對其進行人源化處理。如將鼠源抗體可變區與人抗體恒定區拼接而形成“嵌合抗體”, 或將鼠抗體可變區的互補決定區(complementarity determiningregion, CDR)與人抗體的互補決定區互換構成“人源化抗體”。“嵌合抗體”的人源程度可達60%, “人源化抗體”可達90%~95%。這雖然在極大程度上保持親本抗體的特異性和親和力, 但仍不是真正意義上的人源抗體,仍無法完全避免進入人體后發生排斥反應或超敏反應。
雖然各種抗體展示與篩選技術為制備人源單克隆抗體提供了選擇, 但是由于展示文庫多樣性不足或者抗原使用等方面因素的限制, 獲得理想抗體特別是高親和力單克隆抗體的效率仍然偏低。直接由人B 細胞構建抗體基因人源化小鼠, 并通過自然篩選過程產生高親和力人源抗體是正在發展中的技術變革, 有望成為最具優勢的抗體藥物研發平臺。該技術需要將小鼠抗體基因替換成相應人抗體基因, 并且通過正常的抗體基因重排與克隆選擇過程發育出表達人源抗體的B 細胞。目前, 構建這種人源化小鼠的基本方法是在鼠胚胎干細胞(embryonicstem cell, ESC)中進行同源重組使得鼠原有抗體基因缺失,破壞其免疫系統,再通過顯微注射、逆轉錄病毒載體、酵母人工染色體系統或者精子介導外源DNA轉移等技術將重建的人源抗體胚系基因位點轉入小鼠體內,最終由雜交瘤技術或者抗體庫技術篩選出靶向的單克隆抗體。 HuMAb-Mouse 與XenoMouse 是目前最為成熟的轉基因小鼠技術平臺。由于人源化小鼠的抗體是在體內產生, 經歷正常發育和成熟過程, 其產生的抗體相對于其他技術具有較高的靶結合親和力。但是, 該技術尚存在不足之處, 包括由于僅導入部分人源基因引起的抗體多樣性低, 對小分子化合物免疫原性較弱, 不適合針對生物毒素等對機體有害的人源抗體的制備以及所制備的抗體含有鼠糖基化修飾等。
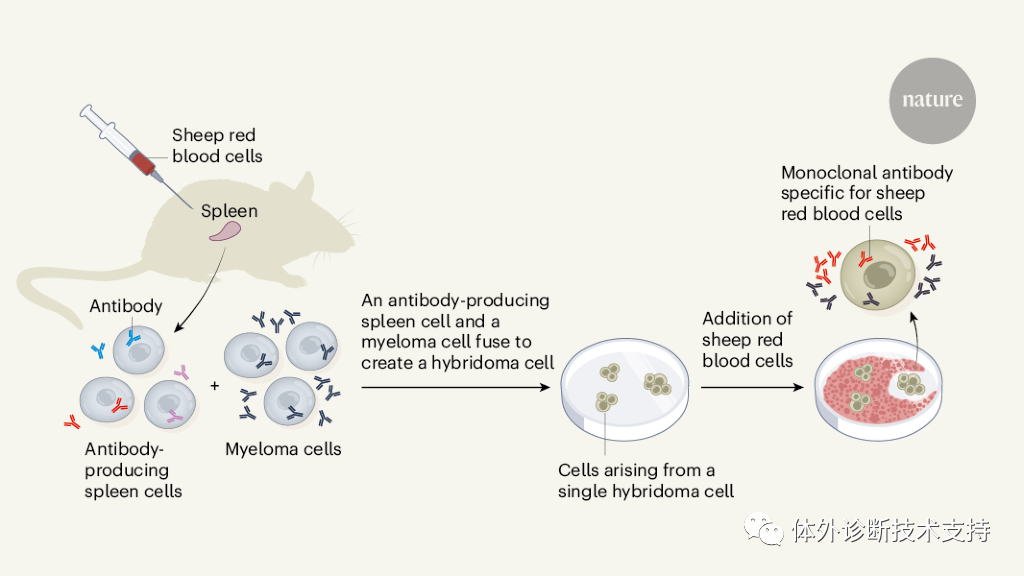
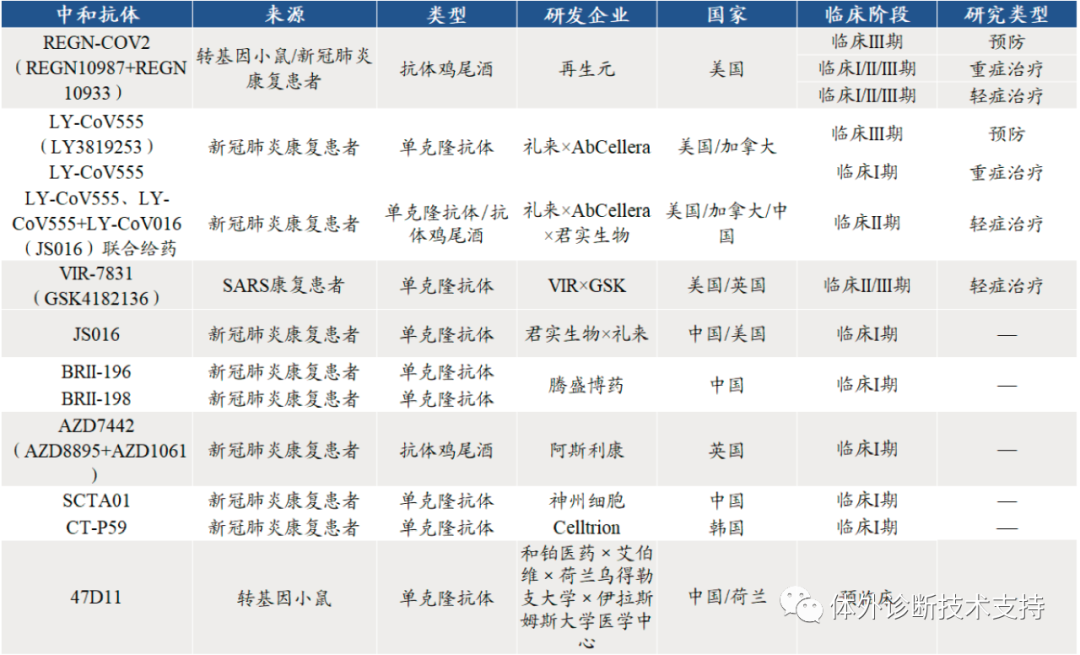
K?hler 和Milstein 的發現創立了具有劃時代意義的單克隆抗體技術, 對生物醫學的影響是巨大的。單克隆抗體在研究中主要用于兩個方面: 第一,用于研究抗體本身的性質及其產生的機理;第二, 用于生產與特定蛋白質或其他特定分子結合的試劑。在第一方面,相比之前無法確保同質性和特異性的抗體制備, 使用新技術生產的高純度、高濃度的單克隆抗體自然對抗體特異性的研究有更大的幫助。此后不久, 人們便發現抗體的可變區(V)和恒定區(C)是由不同的基因片段編碼的。 B 細胞將這些基因片段連接在一起, 便形成了識別不同抗原的抗體。其中具有結合抗原能力的抗體可變區,其基因片段會進行高達1012 種可能性的重組, 抗體庫的多樣性由此產生。另外由于抗原刺激介導的體細胞超突變(somatic hypermutation)使得抗體應答進程中抗體親和力不斷提高, 也就是抗體親和性成熟(affinity maturation)。單克隆抗體技術推動了在分子層面闡釋抗體產生的分子機理。此外, 由于抗體在免疫系統中的核心地位, 單克隆抗體技術的出現, 也讓人們對獲得性免疫和體液免疫有了更進一步、更深層次的了解。在第二方面,單克隆抗體技術提供了對生物大分子(主要是蛋白質)進行準確定性、定量、定位的手段, 如今已經滲透到生物醫學研究的各個方面, 諸如通過細胞表面蛋白標記對細胞進行分類篩選分析的熒光細胞分選技術、展示細胞內特定蛋白定位的高分辨率熒光顯微鏡、檢測蛋白質混合物中特定蛋白表達量的蛋白印跡法(Western blot)、常用于血清中細胞因子表達量測定的酶聯免疫吸附測定(enzyme-linkedimmunosorbnent assay, ELISA)等, 這些技術的特異性和分辨率都離不開高質量的單克隆抗體試劑的助力。值得一提的是, 得益于熒光標記單抗的發展, 我們現在已經能夠在單細胞水平對細胞表面的蛋白質標志物表達圖譜進行高通量的繪制與分析。盡管早期對抗體的產生和作用機制了解得并不透徹, 但是自從被發現以來, 抗體就被醫學界和工業界應用于早期的血清療法、疾病診斷等多個方面。單克隆抗體技術的出現, 更為抗體類藥物的發展插上了騰飛的翅膀。 1986 年, 僅僅在單克隆抗體制備技術誕生10 年后, 美國FDA 就批準了全球首個治療性鼠源單抗, 一種名為muromonab-CD3 的抗CD3 抗體, 用于治療器官移植后同種異體排斥反應。隨后幾十年, 單克隆抗體類藥物在生物醫藥領域得到了飛躍式發展, 如今已經有約千億美元的巨大市場, 并且在可預見的未來仍將繼續增長, 再加上抗體在疾病診斷上難以替代的地位, 單克隆抗體在醫藥領域的應用可謂是公認的成功。最初,把來源于小鼠的單克隆抗體用于人類疾病治療,但在人體內半衰期短且引發免疫排斥風險等問題, 效果并不好。這是因為人體的免疫系統會把小鼠的抗體蛋白識別為“異己”成分, 并產生針對小鼠抗體的抗體; 但小鼠抗體的恒定區段無法和人類細胞的新生Fc 段受體(FcRn, 也被翻譯為滋養層細胞表面相應受體)結合, 從而難以在人體循環系統中穩定存在。為解決這個問題, 1988 年, Greg Winter 團隊首先發展了人源化嵌合單克隆抗體。他們將抗體基因中與特異性無關的恒定區替換為人類抗體的同源區段, 在沒有喪失特異性的前提下提高了單克隆抗體藥物在人體內的穩定性, 這是單抗臨床應用領域的重要進步。人源化嵌合單克隆抗體并不完美, 因為對人體的免疫系統來說, 畢竟嵌合的抗體分子中仍有非人源成分, 人體強大的免疫系統依然能夠識別它們并產生針對嵌合抗體的抗體。為了進一步減少單克隆抗體中的鼠源成分, 研究者們索性將鼠抗體上的超變區氨基酸結構域直接移植至人源的抗體分子, 從而改良出比嵌合抗體更先進一步的、分子結構同源性達到95%的人源化抗體。即使如此, 鼠源抗體的Frame Region 還是無法徹底的人源化, 但是人類追求卓越的腳步并未停止。隨后不久, 借助分子生物學及基因工程技術等的快速進步, 噬菌體抗體庫技術、核糖體展示技術、RNA-多肽融合技術和人類抗體庫轉基因小鼠制備技術的發展最終實現了全人源化抗體的飛躍 。在腫瘤與自身免疫性疾病治療方面, 單克隆抗體獲得的成功尤其令人矚目。現在臨床上使用的利妥昔單抗(Rituximab)就是一種抗CD20 人-鼠嵌合性單克隆抗體, 也是第一個被批準用于腫瘤治療的單克隆抗體, 主要應用于B 細胞非霍奇金淋巴瘤。利妥昔單抗能夠顯著延長腫瘤患者的無進展生存和5 年總生存率, 在腫瘤內科治療史上具有劃時代的意義。而單抗類藥物中的“明星產品”——阿達木單抗(Adalimumab/Humira)則是一種抗TNF-α 全人源化單克隆抗體, 自2003 年美國FDA 批準以來已經在全球90多個國家獲批治療類風濕關節炎、幼年特發性關節炎、強直性脊柱炎、銀屑病關節炎、克羅恩病等15 個適應證, 相關系列產品的年銷售額近200 億美元, 位列全球抗體類藥物銷量首位, 其療效及安全性得到了廣泛驗證與認可。近年來更是誕生了抗體-偶聯藥物、雙特異性及多特異性抗體、抗體融合蛋白、小分子抗體等多種新型單克隆抗體, 使得單抗類藥物具有更大的生命力及發展前途。針對傳染病的單克隆抗體也有其發展前景, 正如百多年前Berhing 和Kitasato 所期待的那樣。新臨床研究顯示,兩種治療埃博拉出血熱的單抗類藥物MAb114 和REGNEB3可有效降低感染者的死亡率, 其療效均優于既往被寄予厚望的其他藥物。 MAb114 是一種從1995 年剛果埃博拉幸存者的血液中提取篩選的單克隆抗體。 REGN-EB3 則是再生元公司開發的3 個全人源化抗埃博拉病毒單克隆抗體組合而成的“雞尾酒”。這兩種單抗類藥物為戰勝埃博拉病毒帶來了新的希望和曙光。同時, MAb114 的成功也再次將康復病人血清抗體的治療作用推向了研究的“風口浪尖”,更讓人們想起了2003 年SARS(severe acute respiratory syndrome)時期, 將病愈個體的血清注入SARS 患者體內從而治愈病患的情況。當前新型冠狀病毒正在全球橫行肆虐, 其傳染性之強、致病率之高讓人措手不及, 而常規臨床“特效藥”的缺乏更是阻礙了疫情的防控及治療。那么此時新型冠狀病毒病愈患者的血清抗體是否可以成為臨床治療的一種選擇,研究者們是否能夠從康復患者血清抗體中篩選出如MAb114 一樣有治療前途的抗新型冠狀病毒單克隆抗體呢?為了尋找新冠肺炎(COVID-19)的有效療法,中和抗體具有預防與治療的雙重作用,有望成為新冠“特效藥”。目前全球共有12 個中和抗體項目進入臨床,其中進展較快的中和抗體研發項目包括由再生元(Regeneron)公司開發的中和抗體雞尾酒療法REGN-COV2,禮來和加拿大AbCellera 公司聯合開發的中和抗體LY-CoV555,Vir Biotechnology 和GSK 聯合開發的VIR-7831。REGN-COV2和LY-CoV555 已進入以預防為目的的III 期臨床試驗階段,三者均已進入以治療為目的的II/III 期臨床試驗階段。國內公司中,君實生物和中科院微生物所合作開發的JS016 領跑,成為中國第一個、全球第二個進入臨床試驗的新冠病毒中和抗體療法。
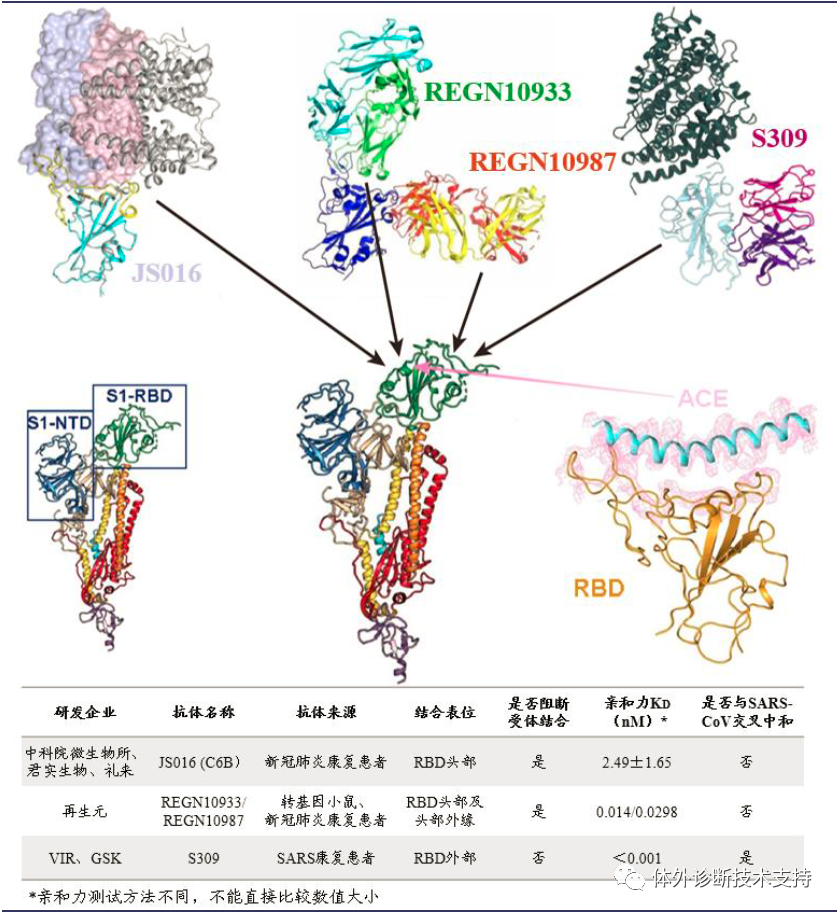

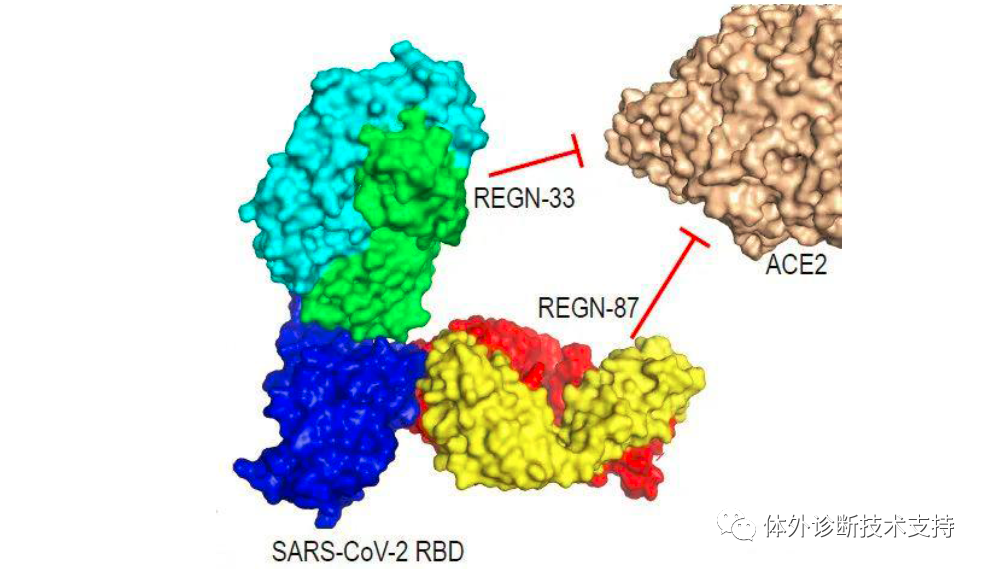
1988 年,再生元(Regeneron)公司由倫納德?施萊弗爾和喬治?雅克波羅斯創立于美國紐約;1991 年,公司在納斯達克掛牌上市。成立之初,再生元的定位是研究神經生長因子,試圖開發治療神經系統疾病的藥物,但先后均已失敗告終。之后公司調整戰略方向,開發出“Trap”技術平臺,并基于此貢獻了著名的眼科藥物EYLEA。同時,再生元還開發并整合了另一個值得稱道的技術平臺VelociSuite?,用于發現、開發和生產人源單克隆抗體,并以此為基礎研發出Praluent,Dupixent,Kevzara 和Libtayo 等成功藥品。發展至今,再生元已經成為一家從事藥物發現、開發、生產和銷售的集成化生物制藥公司,擁有員工8100 人,擁有7 款美國FDA批準上市的藥品。再生元主要有三大核心技術平臺,分別是Trap 技術平臺、VelociSuite?技術平臺和Cell Production 技術平臺。再生元新冠抗體研發項目主要利用VelociSuite?技術平臺中的VelocImmune 的小鼠模型。目前再生元已用該技術成功研發了埃博拉病毒中和抗體藥物REGN-EB3、MERS 病毒中和抗體RGEN3048-3051。新冠疫情爆發后,2020 年2 月3 日,再生元宣布與美國衛生和公共服務部(HHS)合作,共同研發針對新冠病毒SARS-CoV-2 的治療性抗體藥物。根據再生元公司披露的預期進度,3 月已經完成預防和治療性中和抗體的篩選,4 月份推進動物實驗,6 月開始小規模生產,進行初期臨床試驗;并在8 月份擴大生產規模,達到每月幾十萬份的預防劑量或幾萬份的治療劑量。再生元的新冠病毒抗體藥物名為REGN-COV2,是由REGN10987和REGN10933兩個單抗組成的雞尾酒抗體藥物。再生元基于VelocImmune 轉基因小鼠模型和新冠肺炎康復患者血液這兩條途徑初步篩選出200 多個候選抗體,最終根據候選抗體和S 蛋白的結合能力、中和能力以及三維結構表征等參數篩選出兩個最合適的單抗組成“雞尾酒”療法。REGN10987 和REGN10933 非競爭性且同時與SARS-CoV-2 病毒S 蛋白的關鍵受體結合域(RBD)結合,阻斷病毒RBD 與人體細胞受體ACE2 的結合界面。其中REGN10933 靶向處于ACE2 結合界面邊緣的刺突樣環狀區域,REGN10933 從上方結合病毒RBD,極大的阻礙了病毒RBD 和宿主細胞ACE2 的結合;而REGN10987 從正面和左下方結合病毒RBD。
美國國防部簽訂REGN-COV2雞尾酒抗體的制造和供應協議。根據協議,美國政府將花費4.5 億美元購買相當于7-30 萬治療劑量,或42-130 萬預防劑量的REGN-COV2 雞尾酒抗體藥物,具體給藥劑量將在臨床試驗中進行評估并加以確定。再生元預計可在夏末生產出第一批藥物,秋季完成全部的藥物生產。2020 年8 月19 日,再生元與羅氏共同宣布達成新冠中和抗體藥物的生產合作。羅氏擁有全球最大的抗體藥物生產基地,與羅氏合作后,再生元生產抗體藥物的能力將至少提高3.5 倍。兩家公司將合作開發和制造雞尾酒抗體藥物REGN-COV2,再生元負責REGN-COV2 在美國的銷售,而羅氏將負責該藥物在全球范圍內(美國以外)的分銷。2020 年9 月14 日,再生元與牛津大學宣布將開展一項3 期臨床試驗RECOVERY(Randomised Evaluation of COVid-19thERapY),以評估再生元雞尾酒療法REGN-COV2 在2000 名英國住院患者中的治療效果,主要評估REGN-COV2 對患者死亡率,住院時間和通風需求的影響。
瘧疾、流感以及AIDS等常見傳染病的猖獗還催生了廣譜中和單克隆抗體(broadly neutralizingantibodies)的概念。這類單克隆抗體的聯合使用與AIDS 治療領域傳統化學藥物“雞尾酒”療法可能有著異曲同工之意, 人們期望這類藥物的應用可以針對傳染性疾病提供廣泛的預防和保護作用。單抗在生物醫藥領域內更具創新性的嘗試還有許多, 例如利用非抗體類受體的配體結合結構域來替代抗體可變區段的抗體工程技術。然而, 研究發現, 天然的免疫系統有時也會使用類似的花招, 但總體上來說, 至少在目前, 人工設計抗體的手段還無法在效率和特異性上與歷經千萬年進化歷程考驗的免疫系統相比。尤其值得一提的是,免疫檢查點抑制劑藥物anti-PD-1(如已在國內上市的施貴寶公司的納武單抗Opdivo 及默沙東公司的派姆單抗Keytruda)和anti-CTLA-4(如施貴寶公司的易普單抗Yervoy)就是單抗類藥物家族中的重要成果代表。免疫療法背后的詳細作用機制雖然仍未完全解明,但大量基礎和臨床層面的研究正在如火如荼地進行, 這些研究勢必將會提供新的挑戰和視角, 并將繼續推動針對其他靶點的單克隆抗體藥物的發展。現在單克隆抗體的制備已經不再依靠雜交瘤技術, 而是直接從免疫過后的動物或病人體內分離細胞, 再將這些細胞內編碼特定抗體的基因轉入合適的細胞系中, 來制備我們需要的單克隆抗體。隨著技術的不斷發展與完善,單克隆抗體已經滲透在人們生活的方方面面。尤其是在生物醫藥領域, 單克隆抗體已當之無愧地成為主流新秀。科技的發展、人們的需求以及廣闊的前景促使著單克隆抗體研究不斷深入, 我們期望著將來會不斷有更優化的單克隆抗體產品問世, 守護健康, 造福人類。值得我們銘記的是,單克隆抗體過去、現在和明天的傳奇是從1975 年K?hler 和Milstein 在實驗室里制作的那幾個涂上了綿羊紅細胞的瓊脂平板這樣最基礎的科學研究開始的!