新冠肺炎在數月蔓延全球,疫情的傳播程度和嚴重性令人深感擔憂。在繁忙的戰疫期間,中國展示了在全球公共衛生事業上盡心盡力的大國擔當。國內疫情正在退潮,國外困難卻越來越明顯的浮現出來。對此新冠肺炎病毒檢測以及治療藥物研究就越來越重要。全球科研機構以及企業研發人員都積極投入到此次研究中來。
背景
冠狀病毒(Coronaviruses,CoV)屬于尼多病毒目冠狀病毒科,為有包膜的單股、正鏈RNA病毒,分為α,β和γ三個屬。冠狀病毒粒子呈球形或不規則形,有囊膜,大小為80-120
nm。其基因組的5'端帶有帽子結構,其后包含6-10個開放閱讀框(Open reading
frames,ORFs)。占據基因組2/3的第一個閱讀框編碼復制酶,基因組的另1/3主要編碼結構蛋白,一般包括纖突蛋白(spike,S)、小包膜蛋白(envelope,E)、囊膜蛋白(membrance,M)、核蛋白(nucleocapsid,N)。E蛋白和M蛋白主要參與病毒的裝配過程,N蛋白包裹基因組形成核蛋白復合體
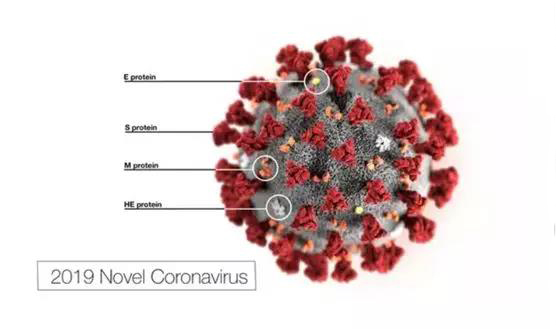
冠狀病毒主要通過刺突糖蛋白(Spike glycoprotein, S glycoprotein)與宿主細胞受體結合介導病毒的入侵并決定病毒組織或宿主嗜性。刺突糖蛋白(S蛋白)是一類很大的三聚體跨膜糖蛋白,其在病毒表面形成特殊的花冠結構,冠狀病毒因此而得名。S蛋白可識別宿主細胞受體并介導膜融合,對于病毒顆粒進入細胞至關重要,是病毒感染宿主細胞的關鍵因子。SARS-CoV-2和2003年的SARS病毒一樣,都是通過識別人類宿主的ACE2蛋白從而進入細胞的,尤其是,S蛋白結構域的細胞受體結合區(Receptor binding domain,RBD)直接參與了宿主受體的識別,該區域的氨基酸變異會導致病毒的種屬嗜性和感染特性的變化。因此,獲取SARS-CoV-2的S蛋白與ACE2蛋白的復合物結構,將有助于理解新冠病毒對比SARS病毒與ACE2結合的差異,以及SARS-CoV-2的S蛋白與ACE2 結合時的存在狀態,因此,SARS-CoV-2的S蛋白與ACE2蛋白的復合物結構為進一步精確地疫苗設計以及抗病毒藥物的發現提供了重要的結構生物學基礎。
在新冠肺炎(COVID-19)疫情爆發之后沒多久,中國科學院上海巴斯德研究所和武漢病毒研究所的科學家就先后發現:新型冠狀病毒和SARS病毒一樣,也是通過利用S蛋白結合人體細胞表面的ACE2蛋白進入細胞的。
從那之后,新冠病毒的S蛋白和細胞表面的ACE2成為科學家們的研究重點。日前,美國德克薩斯大學奧斯汀分校Jason S. McLellan團隊和西湖大學周強實驗室先后利用冷凍電鏡技術分別首次成功解析了S蛋白(spike protein)和ACE2的完整結構,以及完整ACE2蛋白與新冠病毒S蛋白受體結構域(RBD)的復合物結構。
Jason S. McLellan 研究組中,研究人員獲得了處于預融合構象的新型冠狀病毒突刺蛋白三聚體的冷凍電鏡(cryo-EM)結構,其分辨率為 3.5?。三聚體的主要狀態為三個受體結合結構域(RBD)之一向上旋轉為受體可至構象。
生物物理和結構證據表明,較之 SARS 冠狀病毒,新型冠狀病毒的三聚體更容易與細胞表面的 ACE2
蛋白結合。另外,研究者們也測試了幾個已經發表過的 SARS 冠狀病毒 RBD 特異性單克隆抗體,發現它們與新冠病毒 S
突刺蛋白沒有明顯的結合,這表明兩種病毒 RBD 之間的抗體交叉反應性可能受到限制。
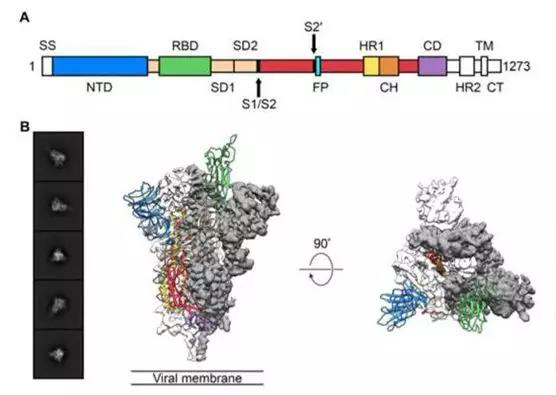
預融合構象中的 2019-nCoV S 蛋白結構
而西湖大學周強團隊則借助于氨基酸轉運蛋白B0AT1,成功在實驗室里獲得了穩定的人細胞受體ACE2的結構,并利用冷凍電鏡技術,解析了ACE2的完整三維結構。
發現了ACE2是以二聚體的形式存在,同時具有開放和關閉兩種構象,而且兩種構象都有與冠狀病毒結合的界面。進一步研究發現,一個ACE2二聚體能結合兩個SARS冠狀病毒的S蛋白三聚體。
此外,還發現ACE2細胞外的那部分(PD)存在6個糖基化位點,這比之前的研究成果多出了4個。

兩個ACE2蛋白聚合在一起
為了揭示ACE2與新冠病毒之間的識別細節,他們獲取了新冠病毒S蛋白的RBD。發現這個RBD就是新冠病毒識別并結合細胞受體ACE2的關鍵。
有了S蛋白的RBD之后,他們將RBD與之前獲得的ACE2-B0AT1復合體,按照接近1:1的比例混合,讓它們自由結合。然后獲得復合物,用冷凍電鏡給它們拍照片。最后獲得了分辨率達2.9?的RBD-ACE2-B0AT1復合體。
基于這個復合體,他們的第一個發現是:雖然ACE2二聚體有開放和關閉兩種構象,而且都有與冠狀病毒結合的界面;但是與S蛋白RBD結合的ACE2-B0AT1復合體只有關閉構象。

RBD-ACE2-B0AT1 復合物的冷凍電鏡密度圖,框內為RBD(黃色)與ACE2(藍色)的相互作用界面
王新泉和張林琦團隊選擇在Hi5昆蟲細胞中表達新冠病毒S蛋白的RBD和人細胞受體ACE2細胞外部分。很顯然,這個研究的目的就是想看清楚新冠病毒S蛋白的RBD與ACE2的結合部分究竟長什么樣。
經過一些列的表達和純化,得到了新冠病毒S蛋白的RBD(Cys336至Glu516殘基)和人細胞受體ACE2細胞外部分(Ser19至Asp615殘基)的晶體結構,然后利用X射線衍射技術,最終獲得了分辨率達到2.5?三維結構圖。
他們發現新冠病毒S蛋白的RBD的18個氨基酸殘基,與人細胞受體ACE2細胞外部分的20個氨基酸殘基結合,結合面積在1700?2左右。對于SARS病毒而言,是16個氨基酸對20個氨基酸。
與新冠病毒結合和SARS病毒結合的那20個ACE2的氨基酸殘基,有17個是一樣的。在新冠病毒RBD與ACE2的結合界面,有17個氫鍵和1個鹽橋;而SARS病毒和ACE2的結合界面,有12個氫鍵和2個鹽橋。
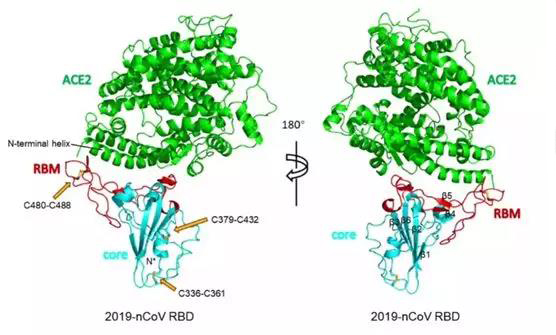
新冠病毒RBD與ACE2結合
這些研究從近原子水平的分辨率解析了新型冠狀病毒 S 蛋白,為進一步精確地疫苗設計以及抗病毒藥物的發現提供了重要的結構生物學基礎,為后續對抗新冠的疫苗和抗病毒藥物研發提供了重要的結構生物學數據支撐。
基于S蛋白及其與ACE2相互作用的治療策略已經在眾多致力于解決這次全球性公共衛生事件的制藥企業和科研院所中廣泛開展并取得了初步的進展。我們相信,隨著更多的研究和臨床試驗拼成一幅完整的拼圖,我們終將打贏這場防疫之戰。
針對新冠病毒,目前依然缺少蛋白類、抗體類的診斷和治療手段。對于新冠病毒的診斷研發,華安生物將以N蛋白和S蛋白為主要研發目標,而針對新冠病毒的抗體藥物治療手段,將以S蛋白和ACE2的中和抗體為研發目標。華安生物研發部已經開發了SARS-CoV-2一系列蛋白及抗體,近期將會上市。
參考文獻:
[1].https://www.biorxiv.org/content/10.1101/2020.02.19.956946v1
[2].https://www.biorxiv.org/content/10.1101/2020.02.19.956235v1
[3].https://www.biorxiv.org/content/10.1101/2020.01.28.923011v1
[4].https://www.biorxiv.org/content/10.1101/2020.02.11.944462v1
[5].http://eprint.las.ac.cn/abs/202002.00004