本文比較分析了國內外李斯特菌的檢測方法、不同標準限量值的差異。介紹了國內外李斯特菌快速檢測技術的應用及存在的問題,對我國微生物快速檢測的現狀進行了概述,探討了李斯特菌快速檢測技術的未來發展方向,對李斯特菌檢驗方法探索及快速檢測技術的發展具有一定的借鑒意義。
李斯特菌(Listeria spp.)廣泛存在于環境中,并且在很多食品有檢出,該菌在低溫的條件下仍能存活和增殖,其中單核細胞增生李斯特氏菌(Listeria monocytogenes)是食源性疾病的主要致病菌之一,也是食品安全控制的重要病原體,感染后會造成不同程度的人員死亡,受到各國的高度重視。傳統方法檢測費時費力而靈敏性較差,因此,快速、高效、靈敏可信的檢測方法能夠更加有效判定李斯特氏菌污染風險并且控制其危害。
李斯特菌的污染及危害
李斯特菌在環境中普遍存在,也是污染食品的主要病原菌,往往侵染肉類、蛋類、禽類、海產品、乳制品、蔬菜等食品。其中,單核細胞增生李斯特氏菌(Listeria monocytogenes)是食源性疾病的重要病原菌, WHO將其列為21世紀四大食源性致病菌之一。單核細胞增生李斯特氏菌廣泛存在于土壤、人和動物的糞便中,在4℃的環境中仍能生長繁殖,是冷藏食品中主要的病原菌之一,往往污染食品導致食源性疾病的暴發。近年來,單核細胞增生李斯特氏菌引起的食源性疾病事件時有發生,并造成不同程度的人員死亡,受到各國的高度重視。
國內外李斯特菌限量規定
李斯特菌極容易污染食品,其中冷藏食品和即食食品危害最為嚴重,各國均制定了食品中李斯特菌的限量值和監測計劃。美國對即食食品中單增李斯特菌的限量規定為0/25g,并要求企業實施GHP和HACCP。中國大陸2013年頒布的《食品中致病菌限量標準GB29921-2013》中規定,在即食肉制品中,單增李斯特菌按照二級采樣方法取樣不得檢出(n=5,c=0,m=0)。
李斯特菌主要檢驗方法
目前,食品微生物檢測體系主要包括,中國的國家標準(GB4789)和檢驗檢疫行業標準(SN)、國際化標準化組織(ISO)方法、美國食品藥品監督局(FDA)、美國農業部(USDA)、美國官方分析化學師協會(AOAC)、加拿大健康保護部(MFLP)、歐盟食品安全局(EFSA)等檢測體系。
食品中單增李斯特菌(Li. monocytogenes)的傳統檢測方法主要包括增菌、分離和鑒定3 個環節。目前,分離環節常會采用顯色培養基,使其菌落顏色不同于其它干擾菌,實現快速分離。鑒定常采用生化反應和血清學反應。目前,生化反應的鑒定技術多采用數值分類鑒定和自動化檢測技術。
表1.單增李斯特菌不同檢測體系介紹
|
方法名稱 |
一次增菌 |
二次增菌 |
分離 |
鑒定 |
快速方法 |
||
|
GB/T 4789.30-2010 |
PALCAM (36±1℃,24-48h) |
動力試驗;染色鏡檢(革蘭氏染色、典型運動);生化特性(MR-VP、糖發酵);溶血試驗;協同溶血;或生化鑒定試劑盒或全自動微生物生化鑒定系統 |
無 |
||||
|
LB1 (30±1℃,24h) |
LB2 (30±1℃,18-24h) |
||||||
|
FDA |
BLEB+Phy (30℃,4h) |
BLEB+Phy+三種抑菌劑 (30℃,20/44h) |
OXA/PALCAM/MOX/LPM+七葉靈+Fe3+ 推薦BCM /ALOA / RapidL'mono /CHROMagarListeria |
藍色菌落*;典型運動或動力試驗;過氧化氫酶;革蘭氏染色;溶血試驗;硝酸鹽還原*;糖發酵;協同溶血;血清學檢驗;小鼠毒力試驗* |
篩選、鑒定都可以使用快速方法 |
||
|
ISO 11290-1(E) |
半量Fraser肉湯 (30℃,24±2h) |
Fraser肉湯 (35或37℃,48±2h) |
OXA和PALCAM (30、35或37℃,24-48h,) PALCAM平板微需氧或好氧條件培養 |
藍色菌落*;過氧化氫酶;革蘭氏染色;動力試驗或典型運動*;溶血試驗;糖發酵試驗;協同溶血;送參考實驗室(血清或噬菌體分型) |
無 |
||
李斯特菌快速檢測技術
傳統方法檢測費時費力操作要求高,因此,李斯特菌快速檢測技術和產品的開發是必要的。美國、歐盟等發達國家對微生物快速檢測方法的研究和產品認證體系相對成熟,各種不同的快檢系統和自動化儀器被推出,并得到廣泛的應用。當前,李斯特菌快速檢測方法為增菌以后,生化鑒定之前,對樣本進行快速篩選,以縮小檢測范圍,減少檢測任務,提高檢測效率。快速檢測方法主要包括酶底物顯色技術、免疫學和分子生物學檢測三大類。
即用培養技術 即用培養基技術則省掉了前期準備工作,可以直接檢測樣品,從而節約了大量人力成本。目前,商業化的固定培養基技術主要有兩種:紙片法和即用平皿法。紙片法是指將顯色培養基固定于紙片上,上方再蓋一層帶有方格的透明薄膜,以方便計數。即用平皿法是指用已倒有培養基的平皿,接種操作與傳統涂板、劃線法一樣。其優點和紙片法一樣,即省掉了前期準備工作,可以直接接種培養。此類產品主要有3M的Petrifilm試紙片、良潤生物的MicroFast?測試片、北京陸橋的Easy test 系列產品及綠洲生化的微生物測試片等,已被許多研究被證明與傳統方法的檢測結果無顯著性差別。
免疫學檢測法 該技術以抗原抗體免疫為基礎,制備特異性克隆抗體檢測細菌。目前國內外李斯特菌快速檢測的此類技術主要包括:酶聯熒光分析法(ELFA)、金標免疫層析技術、流式細胞技術等。ELFA 靈敏度比ELISA 高,并省去了ELISA 中的顏色反應,縮短反應時間;但缺點是成本較高,目前主要應用在自動酶聯熒光免疫檢測系統(VIDAS)上【6】。金標免疫層析技術是將高度特異性抗單增李斯特菌抗原的抗體束縛在色原載體上,且可與固相支撐基質相分離。當檢測樣品中存在李斯特菌時,測試單元的試劑將會被展開,產生肉眼可見的確定性反應。流式細胞術是一種在功能水平上對單細胞或其他生物粒子進行定量分析和分選的檢測手段[6],它可以高速分析上萬個細胞,并能同時從一個細胞中測得多個參數。該檢測技術平均1min 即可得到檢測結果,無需培養和樣品制備,靈敏度可以達到1~100CFU,但儀器投入較大,檢測成本相對較高,對樣本的要求高,嚴重的制約這該技術在食品微生物檢測中的應用。
分子學檢測方法 主要包括核酸探針雜交技術、PCR 檢測技術等。DNA 探針法是將2 條堿基互補的DNA 鏈在適當的條件下雜交,通過檢測樣品與標記性DNA 探針之間形成的雜交分子來檢測樣品中的單增李斯特菌,測定放射性或熒光強度即可得出樣品中單增李斯特菌的個數[7]。PCR 是近年來廣泛應用的分子生物學檢測方法,在單增李斯特菌的檢測中以其遺傳物質高度保守的核酸序列(常用的靶序列包括hly、actA、prfA等)設計引物進行擴增。該方法特異性好,但靈敏度低,對樣品進行前處理后再進行擴增,可以提高檢出率和檢測靈敏度。國內外目前主要應用的PCR技術包括:實時熒光PCR(Real-time PCR)、多重PCR、恒溫擴增、RT-PCR 方法、IMS-PCR 檢測技術等[8]。
增菌快速檢測技術
不管是國標GB方法還是ISO、FDA等方法,李斯特菌檢測必須經過2次增菌后再進行分離鑒定,操作比較繁瑣,操作過程容易造成污染,且耗時較長。MicroFast?李斯特菌快速增菌培養基為一步增菌培養基,即在檢測擴增李斯特菌的過程中不需要二步增菌,因此操作性更方便。具有如下優點:
對培養基進行增菌檢測
在450個食品樣本中添加一定量李斯特菌,建立感染模型,分別用FM快速增菌培養基和國標法規定對培養基進行增菌檢測,結果發現FM培養基對李斯特菌復蘇效果顯著,尤其是檢測冰激凌、奶酪類產品,具體對比如表2所示。
表2. MF培養基與國標培養基在實際樣本檢測中的效果
|
樣本 |
接種水平 CFU/25g |
FM快增培養基 |
國標法檢出 |
|
|
金標卡法檢出 |
培養法檢出 |
|||
|
肉類 |
5 |
19 |
19 |
18 |
|
冰淇淋 |
8 |
20 |
20 |
3 |
|
牛奶 |
3.5 |
34 |
36 |
32 |
|
奶酪 |
3.5 |
19 |
21 |
15 |
|
海鮮、生魚片 |
2.8 |
45 |
45 |
45 |
|
檢出總數 |
137 |
141 |
113 |
|
|
檢出率(總共450樣本) |
30% |
31% |
25% |
擴增速度更快速
通過實驗間比對李斯特菌在四種不同培養基中的生長速度,發現李斯特菌在MicroFast?培養基(以下稱MF)中具有最快的生長速度,圖3表明李斯特菌在MF培養基的生長速度均優于LB1、BLEB和UVM培養基,進口BLEB培養基優于UVM及LB1培養基。
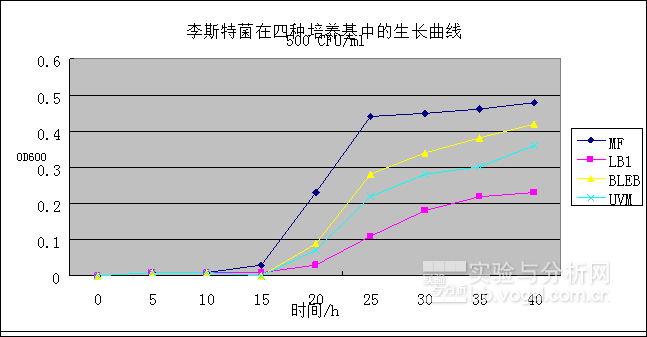
圖1.李斯特菌在不同培養基中的生長曲線。
具有更強的選擇特異性
通過實驗測試,該培養基可以抑制絕大多干擾菌的生長(1/115,即115株非李斯特菌種僅有1株能夠生長)。圖4說明了李斯特屬的菌在FM培養基中都能正常生長,而主要干擾菌菌不能在MF培養基中生長,尤其是乳酸桿菌的抑制,對提高發酵乳中的李斯特菌檢出作用明顯。
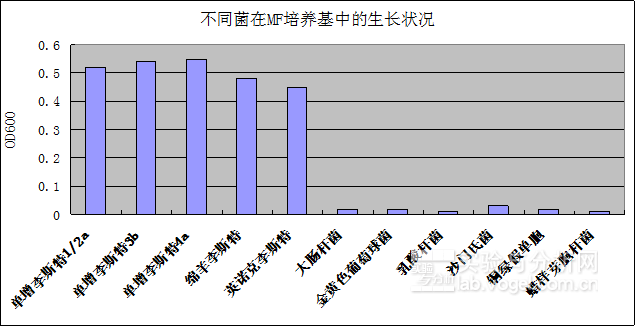
圖2.不同菌在MF培養基的生長狀況
小結
微生物檢測包括前處理、增菌、富集、檢測等環節。為實現快速、實時、準確的監測食品微生物,每個環節都應有相應的篩查技術及產品。我國在微生物快速檢測技術的應用及技術研發方面相對歐洲國家比較落后,快速檢測技術的發展和應用需要政府相關機構、科研單位、企業共同的努力建立一套快速、準確、簡單的檢測體系,此外,還需要降低檢測成本,提供檢測靈敏度和實用性,這些是今后微生物快速檢測的發展趨勢。