三、實施高通量測序PGD/PGS前的臨床咨詢和知情同意書的簽署
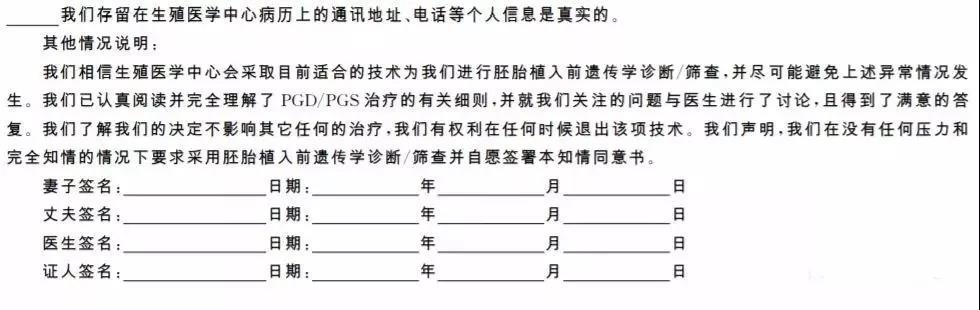
本項技術的實施應堅持知情選擇、自愿的原則,接受本項技術的患者應簽署知情同意書。
1.應用高通量測序技術進行基因疾病PGD是確認診斷,而PGS是排除性診斷。醫師應該事先告知患者及其家屬PGD/PGS的性質、目的、意義和方法及其局限性,以及確認診斷和排除診斷的差異及其可能的風險。應告知患者及其家屬現存可行的替代方法及各自的優勢和局限;
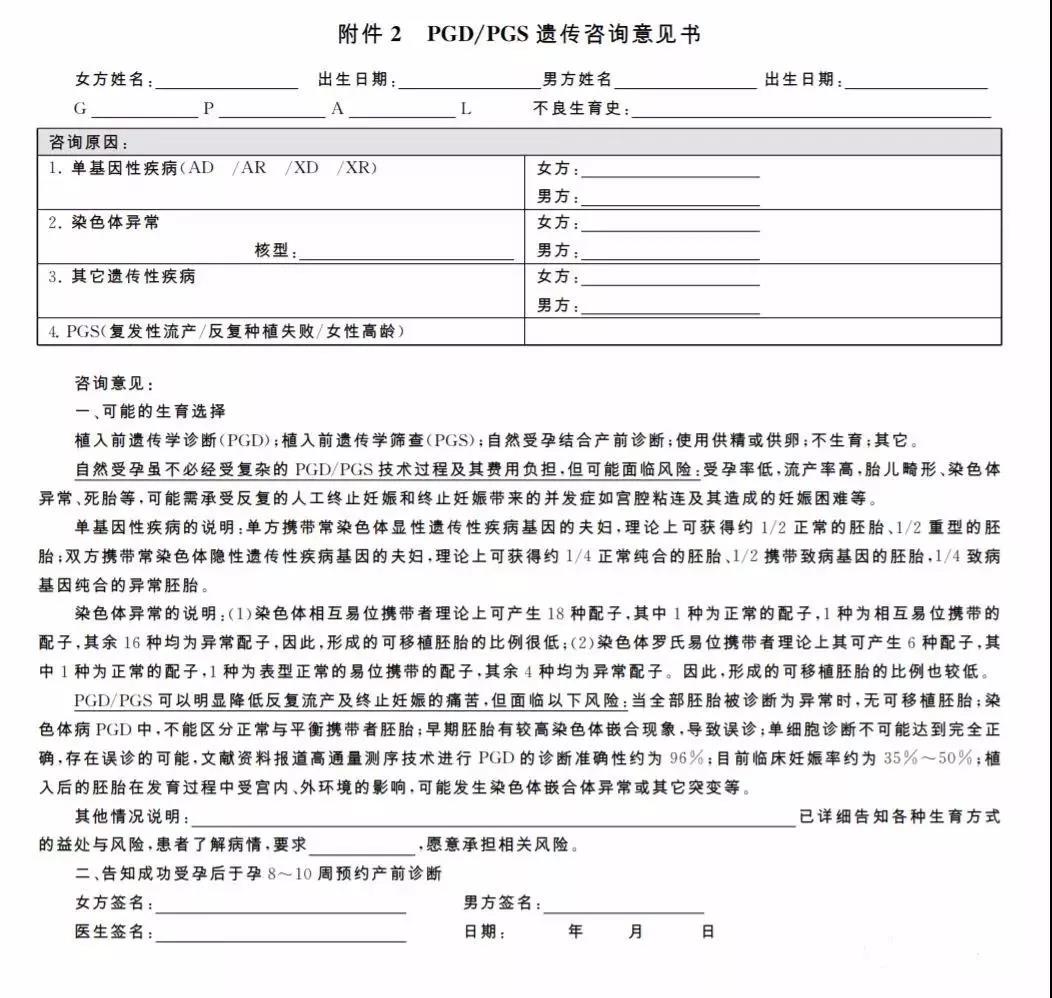
2.簽署知情同意書之前,醫療機構應該有專門負責的醫師對患者進行遺傳咨詢并解釋知情同意書的要點。遺傳咨詢意見書可參考附件2,知情同意書可參考附件3制定。

(1)機構應告知患者本項技術通常能夠達到的檢出率、誤診率及其可能的原因等,應強調經本項技術后的妊娠須適時進行介入性產前診斷以進一步確診,避免誤診的危害;
(2)告知患者本項檢測有失敗的風險,必要時需重新進行活檢;
(3)應告知本項檢測的局限性,如在染色體相互易位的攜帶者中可能無法區分正常和平衡攜帶的胚胎,目前尚難以進行5Mb以下的拷貝數變異的診斷等;
(4)解釋醫師對病例個案認為應該說明的問題以及患者提出的其它疑問。
四、臨床資料的收集和胚胎遺傳物質的活檢
1.臨床資料的收集:臨床醫師應詳細詢問患者的遺傳病的家族史、先證者的情況、致病基因的檢測方法和結果以及孕產史等情況。其必要的原始資料或其復印件應保存在醫療檔案中。
2.胚胎活檢:
(1)依據技術體系的差異,在PGD/PGS中可進行極體、卵裂球或囊胚滋養外胚層細胞等遺傳物質的采樣。根據現階段的循證醫學資料,建議采用囊胚滋養外胚層細胞的活檢;
(2)采用唯一編號對活檢的胚胎生物樣本進行編號;
(3)活檢樣本的處理按全基因組擴增試劑盒說明書進行;
(4)填寫高通量測序檢測申請單。申請單可參考附件4。

3.胚胎活檢生物樣本的儲存和運輸
(1)已進行全基因組擴增的樣本運輸:樣本在4~8℃冷藏條件下冷鏈運輸,運輸時間建議在4h內;在0℃以下的冷凍運輸不超過72h;
(2)已進行全基因組擴增的樣本的長期保存應在-80℃,保存過程中盡量避免反復凍融。
五、高通量測序檢測及其結果的審核和發放
1.本項檢測應在接收到待檢物的30個工作日內完成并出具檢測報告,其中發出因檢測失敗需再次采樣的通知應不長于15個工作日;
2.檢測報告需由醫療機構具副高級及以上職稱、熟悉并從事本項技術的醫務人員審核后以書面形式發放至患者,醫務人員應事先告知患者獲取該報告的時間和地點。檢測報告可參考附件5;

3.報告應包括以下信息:
(1)患者的姓名、年齡、采用本項技術的適應證;
(2)胚胎的編號、胚胎的狀態、采樣日期和報告日期;
(3)檢測的項目和檢測方法以及測試的檢測級別分類(A、B、C);
(4)檢測報告應對每個被檢胚胎的檢測結果以標準的專業方式描述。常染色體隱性遺傳性基因疾病的PGD應明確是正常、致病基因雜合子或純合子,或致病基因復合雜合子(重型)胚胎;常染色體顯性遺傳性疾病的PGD應明確是正常或重型胚胎,染色體病的PGD以是否出現易位和非易位染色體數目和/或結構的改變來表示,PGS以是否出現染色體非整倍體的改變來表示。必要時根據檢測結果輔以其它的描述或說明;
(5)檢測報告還應包括每個胚胎的測序深度,致病基因的直接測序結果及其上、下游可用于單體型分析的SNP位點數;
(6)檢測中發現的拷貝數變異,應根據目前的資料對其進行分類,包括致病性的(5類)、可能致病性的(4類),以及從臨床意義不明到可能良性和良性的(1~3類);
(7)檢測者、審核者;
(8)其它相關提示。
六、檢測后的臨床咨詢
醫療機構應直接向患者夫婦解釋各胚胎的檢測結果,根據檢測結果明確胚胎的處置方式并根據具體情況為患者提供專業建議;對于結果為可移植的低風險胚胎,應提示不排除誤診的可能。
七、移植后妊娠結局的追蹤隨訪
1.對PGD/PGS受術者及其子代的隨訪率必須達100%;
2.隨訪內容包括:胚胎移植后妊娠的情況、產前診斷的結果、產科情況、妊娠結局、胎兒或新生兒的表型等情況以及遺傳學診斷和其它的臨床診斷;
3.各階段應根據具體情況為患者提供進一步處理的建議。
八、資料與標本的保存
實施本項技術全過程相關的原始資料,包括患者的病案、知情同意書、高通量測序檢測申請單、原始實驗數據記錄、相關的電子信息文檔、高通量測序檢測報告單等,均應在醫療機構保存30年以上,相關的電子信息文檔及剩余胚胎生物擴增樣本應保存至產后2年以上。必要時重新進行本項檢測以進一步核實檢測結果。
肆
本項技術的臨床及實驗室質量控制
一、為了切實保障患者及其子代的利益,提高人口素質,參與本項技術的各機構須嚴禁本項技術商業化,嚴禁本項技術被濫用于進行無醫學指征的胚胎性別選擇。
二、活檢的胚胎及其擴增的生物標本采用唯一編號并與申請單及報告單保持一致,標示清晰無破損或污染。
三、應由臨床和實驗室專家制定“核心疾病基因列表”。
四、必須建立所檢測的胚胎的全基因組低覆蓋度測序技術分析拷貝數變異(CNV)的標準化檢測流程。
五、必須建立檢測的胚胎單核苷酸多態性(SNP)或基于短串聯重復序列(STR)的胚胎單體型的數據庫,并具備高通量基因測序技術結合單體型分析的標準化檢測流程。
六、PGS測序產出的數據中能夠唯一比對上參考序列的條數>40萬條。
七、基因性疾病的PGD測序平均深度至少需達到100×;應該進行靶基因上下游緊密連鎖的SNP位點或STR分析,以通過相互印證、多途徑確保最終診斷結果的準確性,降低誤診的發生率。
八、所有關鍵步驟的操作至少由2人完成,一人操作,一人核對并記錄。
九、必須采取保障措施對所有相關數據進行長期存儲。
十、基因性疾病和染色體病胚胎診斷的檢出率不低于96%。