高原是地球上最惡劣的環境之一,最主要的特點是低氣壓所導致的缺氧。急性暴露在低壓缺氧環境下,未習服人群會出現腦損傷,在嚴重情況下甚至會發展成為致命性的高原腦水腫。在我國,大約25%的陸地是海拔高度超過3000米的高海拔區域,并且集中在青藏高原區域,這嚴重阻礙了當地的基礎設施建設、扶貧、經濟開發和國防建設。高原疾病的發病機制復雜,盡管很多關于高原疾病的假說被提出,其具體病理機制依然未被充分闡明,妨礙了高原相關疾病藥物的研發。目前主要有兩類藥物用來防治急性高原病,包括刺激呼吸的碳酸酐酶抑制乙酰唑胺和抗炎的糖皮質激素類可的松,但是這兩種藥物都有較多的副作用。同時,應用一些遺傳背景和人類差異較大的動物研究高原相關疾病,這也可能是制約高原病基礎研究以及藥物研發的原因之一。
2019年,中國科學院昆明動物研究所張國捷團隊利用低壓艙模擬高海拔環境,評估了非人靈長類食蟹猴作為高原疾病動物模型的可靠性。暴露在急性低壓缺氧環境下,食蟹猴出現了與人類高原腦水腫相似的癥狀,包括行為失調、腦含水量升高、神經元受損以及血管源性腦水腫等,這些結果證實了食蟹猴模型適合研究急性低壓缺氧引起的腦損傷。
該團隊對暴露在急性低壓缺氧環境下的食蟹猴白細胞和大腦皮層進行轉錄組測序,來探索急性低壓缺氧引起腦損傷的可能機制。在模擬的平地、3000米、6000米以及7500米等不同海拔高度下收集食蟹猴白細胞RNA樣品進行轉錄測序分析,并關注轉錄譜如何隨著缺氧嚴重程度的增加而動態地發生變化。數據揭示了缺氧應激基因的表達并不完全是隨著缺氧程度的增加而單調遞增,表現出獨特的表達調控模式。大多數缺氧應激基因的表達量僅在前期快速增加,而在缺氧后期出現回復現象,這些基因主要參與經典的缺氧反應通路HIF-1信號、先天性免疫信號以及一些新發現的關鍵性通路,如維生素D受體信號,這些通路可能共同調控了低壓缺氧所導致的炎癥反應。除此之外,另一類基因的表達量在前期缺氧急劇下調,并且在后期保持穩定,這些基因主要與T細胞信號有關。第三類基因的表達量在缺氧前期并沒有改變,反而在缺氧后期急劇增加,這類基因的主要功能包括造血、攜氧以及血紅蛋白相關的炎癥通路等。造血和攜氧是HIF-1信號下游通路,可以提高個體對缺氧環境的適應能力。顯然,不同表達模式的缺氧應激基因相互協作,共同調控了食蟹猴對急性低壓缺氧的反應。
急性低壓缺氧刺激同樣改變了中樞大腦皮層的轉錄調控模式,激活了經典的缺氧反應通路HIF-1信號以及下游的血管發生的調控通路,并抑制了有氧呼吸和蛋白折疊相關的通路。血管發生可以提高供氧能力,但卻會損害血腦屏障,以及導致中央神經系統的炎癥等。而受到抑制的有氧呼吸和蛋白折疊也與腦損傷的病理機制相關。
該團隊進一步評價了孕酮和5α-androst-3β,5,6β-triol(TRIOL)兩種甾體對急性低壓缺氧引起的食蟹猴腦損傷的保護作用與可能分子機制。兩種藥物均顯著減輕暴露在急性低壓缺氧環境中食蟹猴腦含水量升高、神經元受損、血管源性腦水腫等腦損傷,而且神經功能評分也出現了一定的緩解。轉錄組分析顯示,兩種藥物對缺氧引起的白細胞轉錄組改變影響較小,但是在皮層藥物顯著逆轉了急性低壓缺氧引起的轉錄譜改變中,保護了絕大多數基因不再受急性低壓缺氧的調控。整體上,兩種藥物的藥效相似,但功能分析顯示兩種藥物卻作用在不同的通路上,孕酮可以有效地提高紅細胞生成,而TRIOL可以減輕谷氨酸興奮性毒性。
總之,該研究加深了人們對急性低壓缺氧誘發腦損傷病理機制的理解,并為缺氧性腦損傷的藥物研發提供了潛在的候選化合物。上述研究工作以Neuroprotectants attenuate hypobaric hypoxia-induced brain injuries in cynomolgus monkeys為題,發表在Zoological Research上。該文章第一作者是華大生命科學研究院的助理研究員張霈;昆明動物所研究員張國捷為該文章的通訊作者。該工作得到中山大學中山醫學院顏光美團隊和中國人民解放軍陸軍軍醫大學高原軍事醫學系高原醫學重點實驗室高鈺琪團隊的鼎力支持。該研究工作得到國家自然科學基金委等的資助。
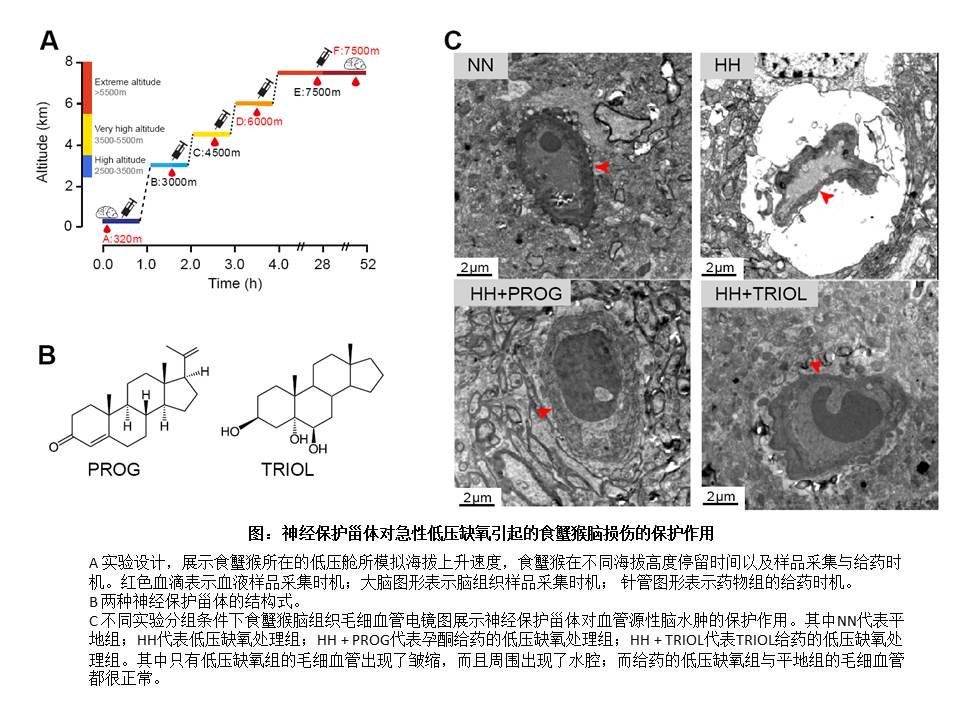
科學家揭示神經保護甾體對急性低壓缺氧引起的食蟹猴腦損傷的保護作用和潛在機制