胰腺導管腺癌(PDAC)是個瘋狂的“殺手”,PDAC患者的10年生存率約為1%[1]。
近20年來,靶向治療和免疫治療不斷取得進步,改寫了很多癌癥的治療范式;遺憾的是,經典腺體亞型對目前的臨床治療方案有一定的響應[2,3],而基底樣間充質亞型的PDAC對標準化療和免疫治療幾乎沒有反應。
PDAC之所如此難治,背后也是有一定的原因的。有研究發現PDAC的腫瘤突變負荷較低,產生的具有免疫原性的新抗原較少,這就使得T細胞難以識別癌細胞;此外,PDAC腫瘤微環境(TME)是免疫抑制性的,使得腫瘤浸潤淋巴細胞(TIL)難以被募集到腫瘤部位[4]。好消息是,最近有研究報道了少量以高水平T細胞浸潤為特征的PDAC病例,而且這種特征與患者的總生存期延長有關[5-7]。
綜合以上研究成果不難發現,將能改善腫瘤微環境的療法與免疫治療聯合使用,或許是治療PDAC的有效方式。
近期,來自德國海德堡德國癌癥研究中心和德國癌癥協會轉化癌癥研究分部的Dieter Saur研究團隊,在Nature Cancer雜志上發表了重要研究成果[8]。
他們通過系統的高通量篩選發現,MEK抑制劑曲美替尼(trametinib)聯合多激酶抑制劑尼達尼布(nintedanib),能夠導致癌細胞周期停滯和癌細胞的死亡,還能促進細胞毒性和效應性T細胞的腫瘤內浸潤。也就是說,二者聯合不僅能殺死癌細胞,還能重編程腫瘤微環境。
更重要的是,曲美替尼+尼達尼布還能讓難治的間質性PDAC對PD-L1抑制劑敏感。總的來說,這個研究為難治性間質性PDAC開辟了新的治療途徑。

眾所周知,超過90%的PDAC患者的KRAS發生激活突變。雖然靶向KRAS突變的藥物已經用于其他癌癥的治療,但是到目前為止,這些藥物還不能有效治療KRAS突變的PDAC。看來突破口可能得從KRAS促癌通路的下游找。
在致癌性KRAS的下游,RAF-MEK-ERK途徑在腫瘤的發生中起著核心作用。MEK抑制劑(MEKi)在RAS突變的黑色素瘤和肺癌中已經展現了較好的抗癌效果,遺憾的是,在PDAC患者中,MEKi卻失敗了。
Saur團隊前期研究發現,致癌性KRAS基因的突變和不斷擴增,推動了PDAC的早期發生和轉移。同時,他們還發現具有高度侵襲性的間充質PDAC的KRAS突變體表達水平最高[9]。
得知KRAS突變體水平對PDAC表型有強烈的影響后,Saur團隊有了新靈感。他們想要開發一種既能夠阻止KRAS驅動的腫瘤細胞內在信號轉導,又能重編程TME的聯合療法,以提高間充質PDAC治療效果。
為了實現上述目標, Saur團隊首先系統地探索了抑制典型的KRAS–RAF–MEK–ERK通路與PDAC治療獲益之間的關系。
他們使用MEKi(曲美替尼)處理了一組原代患者來源的PDAC細胞和常規人類PDAC(hPDAC)細胞系。出乎意料的是,經典腺體亞型hPDAC對曲美替尼高度敏感(圖1b)。
由于臨床標本中缺乏代表未分化程度最高、侵襲性最強、具有完整間充質形態的hPDAC細胞,研究人員拓展了篩選范圍,他們從表達KrasG12D的小鼠胰腺癌中分離出原代PDAC細胞(mPDAC)并重復上述實驗。經檢測,相比經典腺體亞型的mPDAC,間充質亞型的mPDAC細胞中的KrasG12D表達最高水平(圖1c)。與hPDAC一樣,主要是經典腺體亞型mPDAC細胞對曲美替尼敏感,而幾乎所有間充質亞型PDAC都對曲美替尼有耐藥性(圖1d)。
隨后,Saur團隊通過體內外實驗證明,使用MEKi或基因敲除手段完全持續性破壞經典KRAS下游信號,都不足以抑制間充質亞型PDAC腫瘤增長。
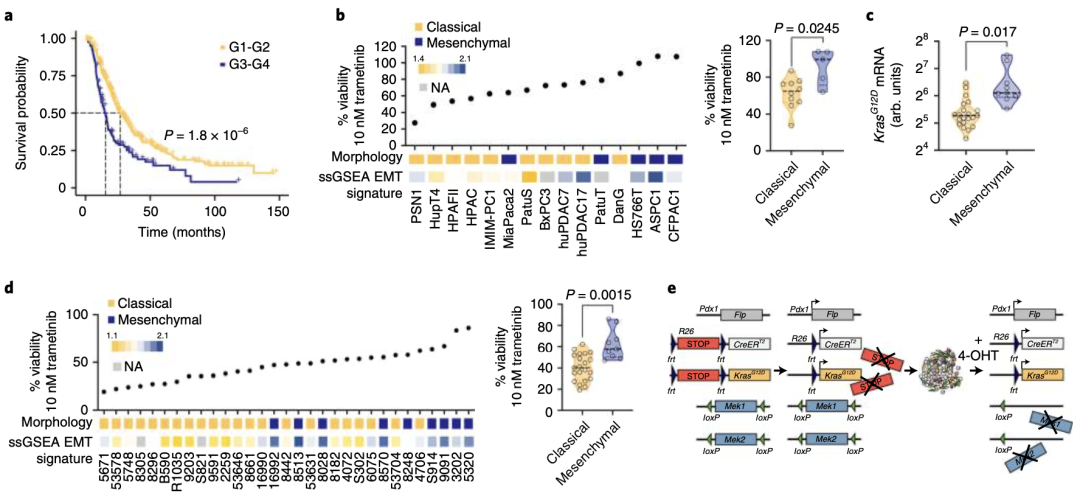
圖1:a、G1–G2或G3–G4腫瘤分級的手術切除患者的生存率曲線。b、hPDAC 細胞系中 10 nM 曲美替尼的細胞活力百分比。c、經典和間充質PDAC中等位基因特異性KrasG12DmRNA的表達。d、mPDAC細胞在10 nM曲美替尼的細胞存活率。
接下來, Saur團隊進行了系統的、高通量的組合化合物篩選,以確定與曲美替尼具有協同作用的藥物。
他們用曲美替尼分別聯合418種藥物,在代表經典腺體亞型和KRAS突變的間充質亞型的人和小鼠的PDAC中進行篩選。經過大量的細胞實驗發現,曲美替尼與尼達尼布(T/N)在人和小鼠間充質亞型的PDAC治療中具有顯著的協同作用。尼達尼布是臨床批準的RTK抑制劑,是治療間充質PDAC的最熱門藥物之一。
為了找到曲美替尼和尼達尼布的直接靶點,研究人員進一步研究了經典腺體亞型及間充質亞型的6種mPDAC,結果發現曲美替尼能選擇性抑制MEK1/2,而尼達尼布的作用靶點廣泛,主要富集在RTK和細胞表面受體中。
隨后,為了確定介導T/N應答相關通路,Saur團隊分析了磷酸蛋白質組的變化。在間充質亞型的PDAC中,一系列重要的癌癥相關通路的活性降低,如調節PI3K/AKT信號的細胞周期調節因子細胞周期蛋白依賴激酶2(CDK2)、細胞周期蛋白D和細胞周期蛋白E、PP2A和IER3、ERBB2、mTOR和KIT下游信號等,以及RAF依賴和非依賴性ERK1/2激活。這些結果表明間充質亞型的PDAC依賴廣泛的RTK驅動的信號輸入。
上述發現提示了需要以多種激酶為靶點,才能在KRAS突變的間充質亞型PDAC中實現有效的治療!
為了進一步破譯T/N協同作用的關鍵基因,Saur團隊在三種間充質亞型的小鼠PDAC細胞中使用了全基因組混合篩選,以及基于CRISPR基因編輯技術篩選。發現在前期實驗中確定的53個尼達尼布靶點中,15個與曲美替尼有功能相關性。
此外,他們還通過CRISPR基因編輯技術,發現多個靶點的組合缺失導致間充質亞型的PDAC對曲美替尼敏感,其中Prkaa1、FGFR1和Map2k5的聯合缺失作用最為顯著。這再一次證實需要廣泛的靶點來有效和全面地治療KRAS突變的間充質PDAC。
令人興奮的體外實驗結果,驅使研究人員構建經典腺體亞型和間充質亞型的小鼠PDAC原位移植模型,以探索體內聯合治療療效。實驗結果發現T/N聯合療法有效抑制間充質亞型的PDAC腫瘤增長,腫瘤體積顯著減少約40%,且小鼠存活率延長一倍(圖2b-d)。
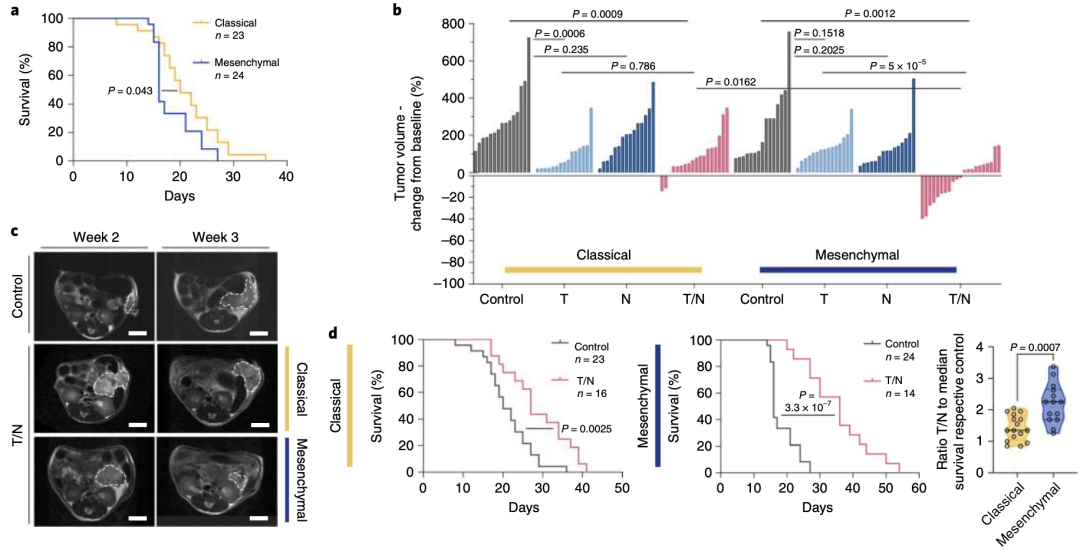
圖 2 a Kaplan–Meier曲線比較經典和間充質原位PDAC模型的存活率。b MRI評估1周治療后經典腺體亞型和間充質型PDAC腫瘤體積變化。c 對照組和T/N治療組小鼠的代表性MRI。d 經典和間充質原位模型的Kaplan–Meier生存曲線。
令人欣喜的是,這是第一種對KRAS突變體基因擴增驅動的間充質PDAC有效的聯合療法!至于背后的機制,Saur團隊發現T/N治療顯著增加了T細胞向間充質PDAC的浸潤,將“冷腫瘤”PDAC轉化為具有免疫響應的“熱腫瘤”。
同時,他們還發現一個有趣的現象。間充質PDAC的腫瘤切片顯示CD8+T細胞浸潤增加在血管周圍最為明顯,他們認為這可能是因為T/N聯合治療重塑了血管導致的。相比之下,經典腺體亞型的PDAC腫瘤卻表現出免疫排斥的特征,僅在腫瘤邊緣有中度富集的T細胞(圖3a-d)。表明T/N聯合治療僅能重編程間充質亞型的PDAC,而對經典亞型的作用并不明顯。
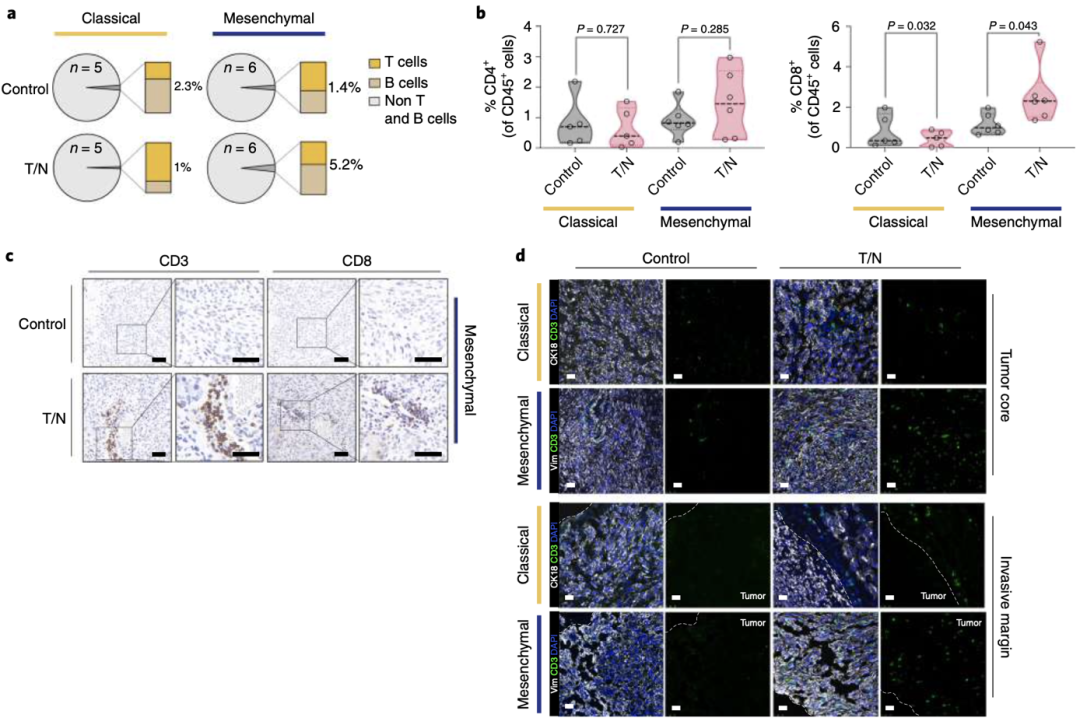
圖 3 a T/N治療小鼠腫瘤中適應性免疫細胞群的比例。b T/N聯合治療1周的腫瘤CD4+和CD8+T細胞的流式統計分析。c T/N治療1周的原位移植間充質模型的腫瘤切片的CD3+和CD8+T細胞的IHC染色的代表性圖像。d CD3+細胞染色組織切片的代表性圖像(綠色)。
隨后,為了研究T細胞在治療反應中的作用,Saur團隊構建了T細胞缺失的小鼠模型,發現T細胞的缺失減弱了T/N的治療效果,間充質PDAC小鼠的生存期也降低了,但與對照組相比,還是一定程度的延長了荷瘤小鼠的生存時間(圖4)。表明T/N起效并非僅由T細胞介導,可能還與TME重編程和藥物對腫瘤細胞直接作用有關。
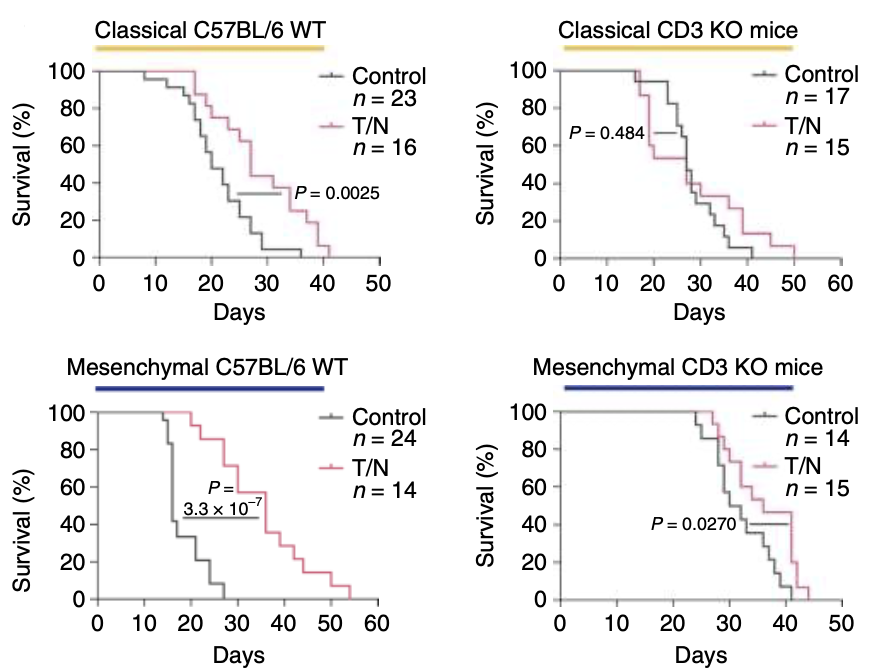
圖 4 CD3敲除和C57BL/6WT小鼠原位移植經典(上)和間充質(下)PDAC的Kaplan-Meier存活曲線
基于上述重大發現,既然T/N能夠促進間充質PDAC癌細胞死亡及重塑其微環境,招募細胞毒T細胞浸潤腫瘤部位,那么是否意味著也能使間充質PDAC對ICB治療敏感?
帶著上面的問題,Saur團隊將T/N聯合PD-L1抑制劑在小鼠間充質PDAC模型上進行了驗證。實驗結果表明,T/N聯合PD-L1抑制劑治療可使腫瘤抑制率高達約80%,并提高間充質PDAC小鼠的存活率,其中位生存期比T/N治療組延長10.5天,與對照組相比延長30.5天。相比之下,在T/N的基礎上聯合PD-L1抑制劑對經典腺體亞型PDAC的影響不大。此外,兩種亞型對單獨使用PD-L1抑制劑均無應答(圖5a、c)。
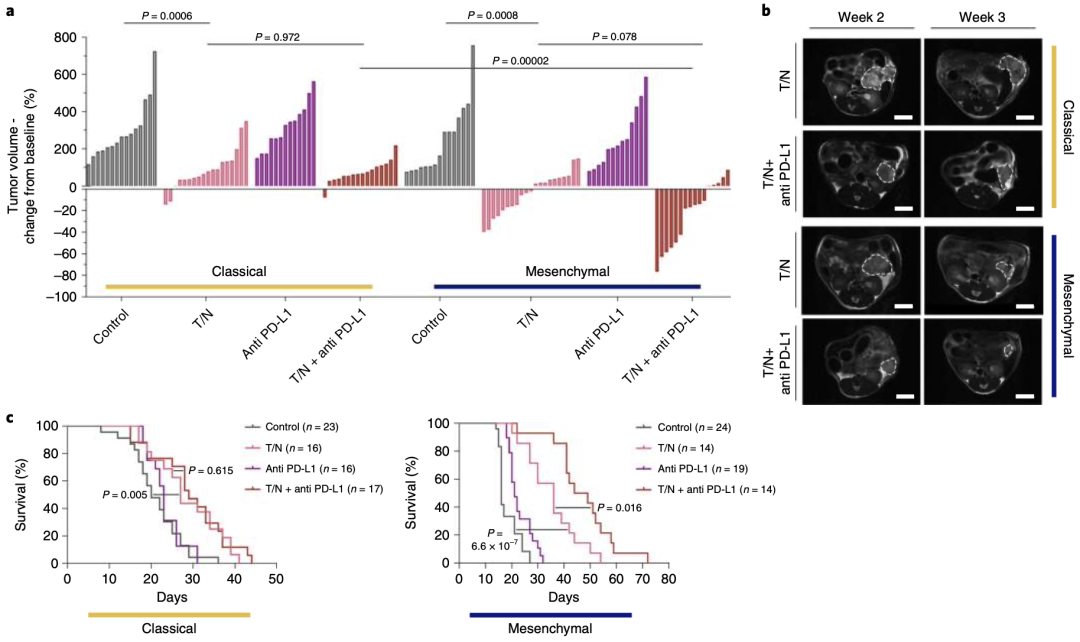
圖 5 a瀑布圖顯示治療1周后,經典腺體亞型和間充質型PDAC對T/N聯合PD-L1抑制劑治療的腫瘤大小變化。c 經典腺體亞型和間充質型PDAC對T/N聯合PD-L1抑制劑治療的Kaplan–Meier生存曲線。
最后,為了全面、客觀地研究T/N治療誘導的TME改變,并從機制上破譯藥物對經典腺體亞型和間質亞型的PDAC腫瘤微環境的作用,Saur團隊還對腫瘤組織進行了單細胞RNA測序(scRNA-seq)。
他們發現,T/N治療的間充質PDAC中具有未成熟T細胞基因表達特征的CD4+和CD8+T細胞顯著減少,而具有功能性細胞毒性、效應和記憶基因表達特征的成熟T細胞顯著增加(圖6b-c)。在T/N的基礎上加入PD-L1抑制劑后,細胞毒性T細胞和效應T細胞進一步增加,幾乎占所有T細胞的75%(圖6b)。此外,在間充質PDAC中,T/N組合特異性地誘導CXCL12、CXCL16和TNFSF12的分泌,而CCL2、CSF1和LGALS9的表達下調。
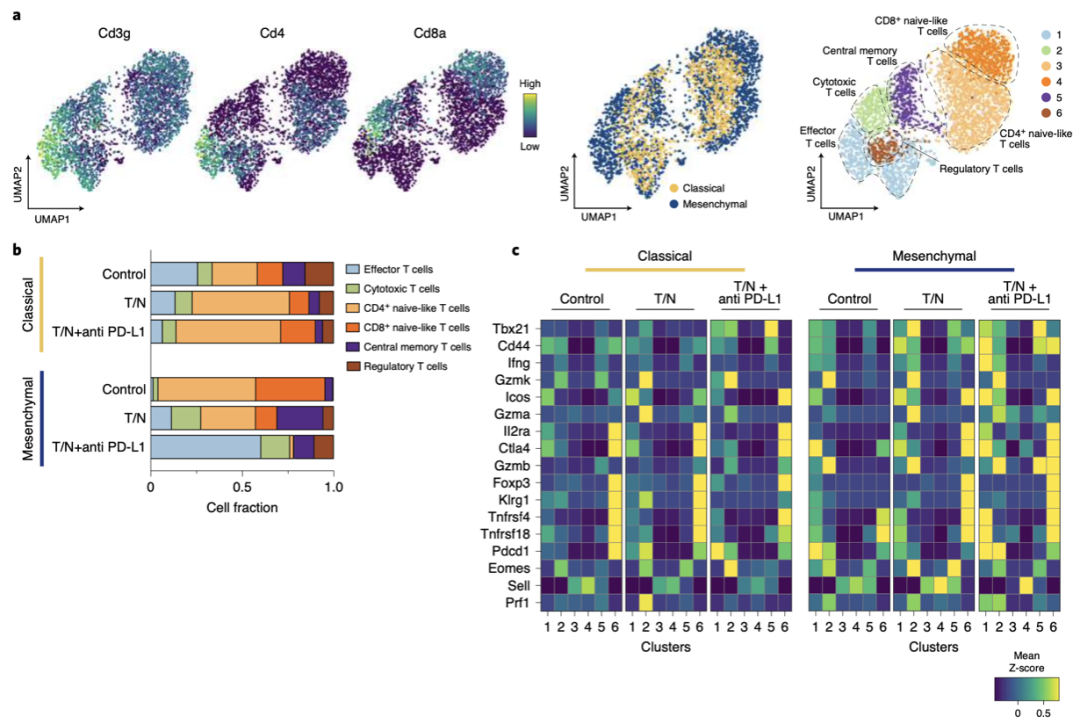
圖 6 a 左:UMAP圖顯示了CD3g、CD4和CD8a標記基因在經典性和間充質PDAC中通過scRNA-seq鑒定的整個T細胞群體中的表達。中圖:所有治療組和對照組的經典PDAC的T細胞(黃色)和間質PDAC的T細胞(藍色)的UMAP圖譜。右圖:UMAP圖顯示了scRNA-seq鑒定的6個T細胞亞群。b 按治療條件和PDAC亞型劃分的細胞比例,通過對a中注釋的T細胞簇的scRNA-seq分析。c經典和間充質PDAC的選定T細胞簇中選定基因的表達熱圖。
綜上所述,T/N治療能夠激活間充質PDAC的TME,從而有利于ICB治療。
總的來說,Dieter Saur團隊的研究,通過單細胞RNA測序、CRISPR篩選和免疫表型分析等方法,發現曲美替尼和尼達尼布聯合療法能夠重塑間充質PDAC的腫瘤微環境,促進細胞毒性T細胞和效應T細胞在腫瘤內的浸潤,從而使間充質PDAC對PD-L1抑制劑敏感。
本研究結果為治療高度侵襲性和難治性KRAS突變的間充質PDAC開辟了新的思路和途徑,這種聯合療法或能應用于其他對免疫治療響應差的難治性腫瘤中。除此之外,還提示我們,在體外篩選到臨床實踐的藥物研發中,應考慮對TME進行重塑以增強抗腫瘤作用。
參考文獻:
[1] Quaresma M, Coleman M P, Rachet B. 40-year trends in an index of survival for all cancers combined and survival adjusted for age and sex for each cancer in England and Wales, 1971-2011: a population-based study[J]. Lancet, 2015, 385(9974): 1206-18.
[2] Aung K L, Fischer S E, Denroche R E, et al. Genomics-Driven Precision Medicine for Advanced Pancreatic Cancer: Early Results from the COMPASS Trial[J]. Clin Cancer Res, 2018, 24(6): 1344-1354.
[3] S N K, Wilson G W, Grant R C, et al. Morphological classification of pancreatic ductal adenocarcinoma that predicts molecular subtypes and correlates with clinical outcome[J]. Gut, 2020, 69(2): 317-328.
[4] Morrison A H, Byrne K T, Vonderheide R H. Immunotherapy and Prevention of Pancreatic Cancer[J]. Trends Cancer, 2018, 4(6): 418-428.
[5] Balachandran V P, ?uksza M, Zhao J N, et al. Identification of unique neoantigen qualities in long-term survivors of pancreatic cancer[J]. Nature, 2017, 551(7681): 512-516.
[6] Chen D S, Mellman I. Elements of cancer immunity and the cancer–immune set point[J]. Nature, 2017, 541(7637): 321-330.
[7] Ino Y, Yamazaki-Itoh R, Shimada K, et al. Immune cell infiltration as an indicator of the immune microenvironment of pancreatic cancer[J]. Br J Cancer, 2013, 108(4): 914-23.
[8] Falcomatà C, B?rthel S, Widholz S A, et al. Selective multi-kinase inhibition sensitizes mesenchymal pancreatic cancer to immune checkpoint blockade by remodeling the tumor microenvironment[J]. Nature Cancer, 2022.
[9] Mueller S, Engleitner T, Maresch R, et al. Evolutionary routes and KRAS dosage define pancreatic cancer phenotypes[J]. Nature, 2018, 554(7690): 62-68.
癌癥是現代社會揮之不去的陰影。與健康細胞相比,癌細胞行為的改變是由蛋白質過度表達引起的。這些蛋白質具有促進細胞增殖、存活和遷移等功能,其中一些蛋白質很容易被靶向和抑制,而另一些蛋白質則不易被小分子或抗......
西班牙巴塞羅那生物醫學研究所團隊開發出一種名為DiffInvex的創新計算框架,其可追蹤健康細胞轉變為腫瘤,以及腫瘤在化療過程中的基因進化壓力。DiffInvex被應用于超過11000個樣本,涵蓋了大......
盡管癌癥的發生和發展通常與體細胞突變的積累有關,但大量的表觀基因組改變是腫瘤發生和癌癥易感性的許多方面的基礎,這表明遺傳機制可能不是惡性轉化的唯一驅動因素。然而,是否純粹的非遺傳機制足以啟動腫瘤發生,......
2015年,中信湘雅生殖與遺傳專科醫院(下稱中信湘雅)成功阻斷一例視網膜母細胞瘤(RB1基因突變)的遺傳傳遞,誕生了我國首個“無癌寶寶”。十年過去,“無癌寶寶”健康狀況如何?這項技術又有哪些新進展?4......
計算機斷層掃描(CT)產生的輻射可能導致罹患肺癌、乳腺癌和其他癌癥,嬰兒風險增加10倍。據美國加州大學舊金山分校(UCSF)的最新研究,每年CT導致的癌癥約占所有癌癥病例的5%。該研究警告,應避免過度......
“很可惜,作為科技期刊出版大國,我們到現在還沒有一個類似《自然》和《科學》那樣的國際頂級期刊。”香港科技大學(廣州)副校長吳宏偉委員向科技日報記者表示,國內期刊與國際頂級期刊的差距主要是在影響力上。中......
最近,《柳葉刀》發表社論文章指出,當前全球癌癥防治中存在著巨大的不平等,迫切需要相應的數據用于制訂癌癥防控計劃,腫瘤登記相關的真實世界數據因此變得至關重要。腫瘤登記是衡量一個國家癌癥負擔的金標準,能幫......
當鋰電池的壽命即將終結時,為它“注射”一針新分子,就能使它恢復原本的充電容量,甚至使得原本只能保證6-8年/1000-1500次充放電的電池,維持1萬次充放電,且電池健康水平與出廠時幾乎仍然一樣。這是......
從先進的免疫療法到自驅動實驗室,從生物修復到光子計算,英國《自然》網站在近日的報道中,列出了2025年值得關注的技術方向。這些技術圍繞可持續性和人工智能(AI)這兩大核心關鍵詞,將掀起新一輪創新浪潮。......
近日,中國科學院地理科學與資源研究所副研究員劉海猛聯合中國農業大學等單位提出了一個人地關系評價的新方法,對2000—2020年中國網格尺度的人地關系進行了系統評估,發現人與自然在中國大部分區域正逐步趨......